ولتامتری
در روشهای ولتامتری با الکترود جامد، از پلاتین، طلا یا کربن شیشه ای بهعنوان الکترود کار استفاده میشود. پلاتین یا طلا درون یک میله شیشهای فرو برده شده، اما کربن به شکل میله استفاده میشود. محلول مورد تجزیه باید از اکسیژن پاکسازی شود و الکترولیت بی اثر نیز استفاده شود. یک ولتاموگرام نمونهای در شکل (۱)، نشان داده شدهاست. جریان حد با حدI (یا Ilim) نمایش داده میشود و متناسب با غلظت آنالیت است. توسط این روش، علاوه بر واکنشهای کاهشی، واکنشهای اکسیدی را نیز میتوان، مطالعه کرد.
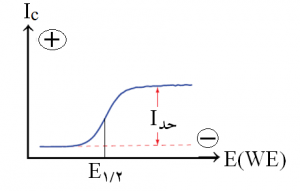
شکل ۱- یک ولتاگرام نمونهای با الکترود جامد.
در ولتامتری الکترود جامد، نیز عامل تعیین کننده مقدار حدI، نفوذ است، بنابراین، فرایند انتقال جرم توسط نفوذ انجام میشود. جریان حد که در تجزیۀه کمّی استفاده میشود، از معادلۀ (۱)، بهدست میآید.
| (۱) | Ilim = (ηFDAc) / d |
که در آن η اضافه ولتاژ غلظتی، F عدد فاراده، D ضریب نفوذ آنالیت برحسب مترمربع بر ثانیه، A مساحت سطح الکترود برحسب ، c غلظت مولار آنالیت و d ضخامت لایه دوگانه الکتریکی برحسب متر است. بنابراین عوامل تعیین کننده حدI، ضریب نفوذ آنالیت و غلظت آنالیت هستند.
ولتامتری روبش خطی و چرخه ای
تفاوت اصلی پلاروگرافی و ولتامتری ماهیّت الکترود کار (WE) است. در پلاروگرافی الکترود قطره جیوه (DME) به عنوان WE استفاده می شود، درحالیکه WE به کار گرفته شده در ولتامتری معمولاً الکترود جامد است. الکترود قطره جیوه آویزان (HMDE) گاهی در ولتامتری استفاده می شود. مانند پلاروگرافی، ولتامتری نیز یک روش تجزیه میکرو است، زیرا فقط بخش کوچکی از محلول در الکترود مورد فرایند قرار می گیرد.
پتانسیل الکترود کار با سرعت پویش ν برنامه ریزی می شود. نمودار حاصل جریان برحسب پتانسیل ولتاموگرام نامیده می شود. در ولتامتری روبش خطی (LSV)، پتانسیل الکترود کار از پتانسیل آغازین (Ei) تا پتانسیل نهایی (Ef) برنامه ریزی می شود. در شکل (۲)، یک ولتاموگرام روبش خطی برای کاهش آنالیتی در فاز محلول، برحسب سرعت پویش نشان داده شده است. لازم به توجه است که محور x به صورت تابعی از اضافه ولتاژ ترسیم شده و پیک درست بعد از ° = η اتفاق افتاده است.
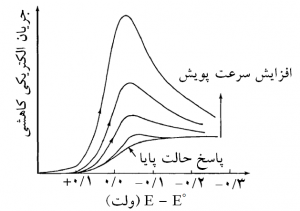
شکل ۲- ولتاموگرام روبش خطی برای واکنش کاهش در الکترود جامد به صورت تابعی از سرعت پویش ν .
در طی ولتامتری چرخه ای (CV) نیز پتانسیل از مقدار آغازین (Ei) برنامه ریزی می شود، ولی در پایان روبش خطی آن، جهت پویش پتانسیل برعکس می شود و در مقدار آغازین (Ei) متوقف می شود، یا ممکن است در یک پتانسیل دیگر شروع شود. پتانسیلی که در آن جهت روبش برعکس می شود، به پتانسیل سوئیچ (Eλ) معروف است. تقریباً به طور عمومی، سرعت پویش بین Ei و Eλ همان مقدار بین Eλ و Ei است. مقادیر سرعت پویش رفتν و برگشتν همیشه با اعداد مثبت نوشته می شود. در شکل (۳)، ولتاموگرامی برای یک زوج ردوکس ساده در فاز محلول نشان داده شده است. چنین نموداری به ولتاموگرام چرخه ای (CV) معروف است. عبارت چرخه از لوپ بسته درون نمودار ناشی می شود. ولتاموگرام چرخه ای (CV) نشان داده شده در شکل (۳)، نمونه ای برای یک زوج ردوکس کاملاً برگشت پذیر ترمودینامیکی است. همان طور که مشاهده می شود، در دو طرف ولتاموگرام چرخه ای یک پیک تشکیل می شود. اگر فرایند کاملاً برگشت پذیر باشد، این پیکها از نظر شکل مشابه و اندازه آنها یکسان خواهد بود. اگر پویش از Ei منفی شروع شود، کاهش در طی قسمت رفت و اکسایش در طی قسمت برگشت ولتاموگرام چرخه ای اتفاق می افتد (شکل ۳).
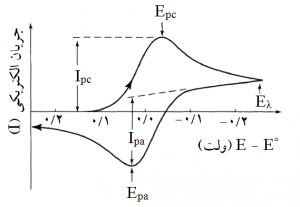
شکل ۳- طرح واره ای از ولتاموگرام چرخه ای برای واکنش کاهش در یک الکترود جامد.
مانند سایر روشهای ولتامتری، مقدار جریان الکتریکی با غلظت متناسب است. بنابراین، برابر بودن (رفت)Ip و (برگشت)Ip (که در آن p معرف پیک است)، دلالت بر بازیابی کمّی ماده شرکت کننده در واکنش الکتروشیمیایی دارد، که از قوانین فاراده پیروی می کند. در پایان ولتاموگرام چرخه ای، وقتی که پتانسیل به Ei رسید، هنوز مقدار کوچکی جریان الکتریکی وجود دارد، که نشان می دهد مقدار اندکی از ماده هنوز کاهیده نشده و در کنار الکترود باقی مانده است. اگر پتانسیل اعمالی به الکترود بسیار منفیتر از Ei باشد، این جریان باقیمانده جزئی نیز به صفر خواهد رسید. در ولتاموگرامهای چرخه ای، پتانسیل پیک، Ep نامیده می شود. پس پتانسیل پیک کاتدی Epc و پتانسیل پیک آندی Epa است. در پلاروگرافی، پتانسیل نیمه موج از تجزیه و تحلیل شکلهای موج پلاروگرافی به دست می آید. این پتانسیل مشخصه مفیدی از آنالیت (مانند° E) است. در ولتامتری چرخه ای، وضعیت هر دو پیک (هر دو پیک رفت و برگشت در (شکل ۳)، یا به ترتیب، کاتدی و آندی در این مثال)، اطلاعات ترمودینامیکی ارائه می دهند. اگر زوج ردوکس کاملاً برگشت پذیر باشد، دو پیک در دو طرف پتانسیل فرمال الکترود (°′E) زوج ردوکس آنالیت، به شرح معادله (۲)، قرار می گیرند.
| (۲) | E°′ = ۲ / (Epa + Epc) |
بهبود حساسیت با روشهای تپی
حساسیت تجزیه ای پلاروگرافی کلاسیک یا روشهای ولتامتری اغلب در حدود ۵-۱۰×۵ است. در کمترین غلظتهای آنالیت، جریان های ایجاد شده توسط اثرات لایه دوگانه یا سایر منابع غیرفارادهای باعث می شود که صحت به صورت غیرقابل قبولی کم شود. اولین بار در دهه ۱۹۵۰، روشهای تپی برای بهبود حساسیت اندازه گیریهای پلاروگرافی، توسط شرکت های دارویی توسعه یافت. در حال حاضر، دو روش تپی (۱) تپی نرمال و (۲) تپی اختلافی، در زمینه شیمی تجزیه غالب شده اند. روشهای موج مربعی نیز به طور پایایی رشد کرده و محبوبیت پیدا کرده است.
ولتامتری تپی نرمال
اگر الکترود کار در طی بیشترین عمر خود غیرقطبی باقی بماند، بیشترین بهبود در حساسیت به دست می آید. برای این منظور، تپهای موج مربعی موفقی به الکترود کار، اعمال می شود. برای مثال، اگر الکترود کار قطره جیوه باشد، با یک تپ به ازای هر قطره، تپهای موج مربعی مناسبی به الکترود اعمال می شود. قطره ها عمر نسبتاً کوتاهی (حدود ۱/۵ ثانیه) دارند. برای اکثر زمان پتانسیل قطره طوری است که هیچ الکترولیزی نمی تواند اتفاق بیافتد. این پتانسیل، پتانسیل پایه (Eb) نامیده می شود. زمان الکترولیز با چنین روش تپی نسبت به زمان قطبش پیوسته، به روشنی کوتاهتر است و در نتیجه، ناحیه تهی سازی اطراف الکترود، هرگز مجاز به وسیع شدن نیست. اگر جریان الکتریکی فقط در طی چند میکروثانیه آخر هر تپ نمونه برداری شود، میانگین پلاروگرافی DC نمونه برداری شده نیز می تواند افزایش یابد. در عمل، ولتاموگرام حاصل از روش تپی، شکلی بسیار شبیه آنچه در ولتامتری نرمال وجود دارد، ایجاد می کند. با این تفاوت اصلی که اثر دندانه دندانه ای حاصل از نوسانات جریان از میان رفته و جریان الکتریکی شامل یک سری قسمت های تخت کوتاه است. در نتیجه، ولتاموگرام ظاهر بسیار واضحی دارد (شکل ۵). همچنین، ارتفاع موج پلاروگرافی تپی، که به عنوان علامت تجزیه ای برای تعیین غلظت استفاده می شود، به اندازه معنی داری از ارتفاع موج پلاروگرافی کلاسیک، بزرگتر است. در نتیجه، غلظتهای بسیار کمتر، جریان الکتریکی قابل اندازه گیری ایجاد کرده و حد تشخیص با پلاروگرافی تپی به حدود ۸-۱۰ الی ۷-۱۰ مولار بهبود می یابد.
ولتامتری تپی اختلافی
از جنبه های زیادی، ولتامتری تپی اختلافی بسیار شبیه پلاروگرافی کلاسیک و روشهای تپی نرمال است. در این روش، یک برنامه پتانسیل خطی dE/dt به الکترود کار اعمال می شود. با این وجود، مشترک با ولتامتری تپی نرمال، تپهای موفقی نیز به الکترود کار اعمال می شود. اختلاف بین پتانسیل پایه و پیک E ∆ (ثابت) است. در ولتامتری تپی نرمال، هیچ الکترولیزی در زمانهای بین هر تپ اتفاق نمی افتد، زیرا پتانسیل پایه (Eb) ثابت است و برای این که جریانها صفر شود، پتانسیل به اندازه کافی آندی انتخاب می شود. برعکس، چون پیکها بر پتانسیل پایه سوار شده اند، پیکهای به دست آمده در طی ولتامتری تپی اختلافی مربعی نیستند، زیرا قسمت تخت پیک با سرعت ثابت dE/dt که خط پایه جلو می رود، افزایش می یابد.
ولتامتری تپی موج مربعی
ابزار الکتروشیمیایی جدیدتر دیگر، ولتامتری تپی موج مربعی است که اغلب بیشتر از ولتامتری تپی نرمال یا ولتامتری تپی اختلافی، به کار گرفته می شود. در این روش، پتانسیل موج شکلی به الکترود کار اعمال می شود. یک جفت اندازه گیری جریان انجام می شود. این اندازه گیریها برای هر دوره زمانی موج یا چرخه، انجام می شود، که به همین علت به صورت زمانهای بعد از tο (زمان شروع چرخه) رسم می شوند. جریان مربوط به قسمت رفت تپ، رفتI و جریان مربوط به قسمت برگشت، برگشتI نامیده می شود. ولتامتری موج مربعی برای یک الکتروشیمیدان چند مزیت ارائه می دهد. اول این که اختلافI بزرگتر از رفتI یا برگشتI است، در نتیجه، ارتفاع پیک ولتاموگرام به سهولت قرائت شده و به موجب آن صحت افزایش می یابد. لذا در شرایط بهینه، حد تشخیص حدود ۸-۱۰ مولار حاصل می شود.
ولتامتری برهنه سازی
دو روش برهنه سازی و ولتامتری را می توان برای ایجاد یک روش قدرتمند به نام ولتامتری برهنه سازی، ترکیب کرد. همان طور که مشاهده می شود، پتانسیل الکترود کار در طی آزمایشهای پلاروگرافی و ولتامتری به صورت صعودی یا نزولی برنامه ریزی شده، سپس جریان الکتریکی حاصل، سرعت رسیدن آنالیت الکتروفعال به سطح الکترود را نشان می دهد، که جریان I متناسب با شار j است.
مقدار جریان پیک (Ip) ولتامتری، با غلظت آنالیت متناسب است. در نتیجه، به سهولت می توان یک نمودار درجه بندی Ip برحسب [آنالیت] از استانداردهای معلوم رسم کرد. سپس با اندازه گیری Ip آنالیت، یک تجزیه را انجام و غلظت آن را قرائت کرد. این روش، عموماً یک روش کاملاً خوب است. رایجترین شکل ولتامتری برهنه سازی، ولتامتری برهنه سازی آندی (ASV) است. مانند برهنه سازی نرمال، در اینجا نیز از یک الکترود قطرۀ جیوۀ آویزان (HMDE) به عنوان الکترود کار استفاده می شود. HMDE برای تخلیۀ محلول، کاتدی می شود. مقدار جریان پیک (Ip) حاصل، با تعداد مول آنالیت درون ملغمۀ جیوه متناسب است. برای کار خیلی صحیح، انتگرال مساحت زیر پیک گرفته خواهد شد. در شکل (۹)، نمودار ASV مس که در سطح HMDE پیشتغلیظ شده و سپس به طور اکسایشی برداشته شده، نشان داده شده است. ولتامتری برهنه سازی کاتدی (CSV) بسیار نادرتر از ASV است، ولی برای تعیین برخی آنیونها مانند هالیدها، سولفید و غیره بسیار مفید است.
اگرچه روشهای ولتامتری را می توان با دستگاه پلاروگراف نیز انجام داد، ولی دستگاههای پتانسیواستات- گالوانواستات با قدرت بیشتر برای اجرای روشهای ولتامتری از نظر تجاری در دسترس هستند. توسط این دستگاه با انتخاب روش ولتامتری مناسب، می توان رفتار الکتروشیمیایی مواد مختلف را بررسی کرد. همچنین، امکان بررسی خوردگی در آلیاژها و تجزیه کیفی و کمی مواد آلی، داروها، یونهای فلزی و ترکیبات بیوشیمیایی با دقت و صحت بسیار مطلوبی امکانپذیر است.

دستگاه پتانسیواستات- گالوانواستات مدل Pgstat 100 ساخت شرکت Autolab
منبع: کتاب شیمی تجزیه ۲، تألیف دکتر محمود پایه قدر ، شیمی تجزیه ۲ (رشته شیمی)
استفاده از مطالب با ذکر منبع بلامانع است



بهترى معلومات است
تعقىبش کنىد
بهترىن سایت براى اموزش است
با سپاس
بهترىن معلو مات است
تعقىبش کنید