نیاز شیمیایی اکسیژن (COD: Chemical Oxygen Demand) چیست و چگونه تعیین می شود؟
در شیمی محیطی، نیاز شیمیایی اکسیژن یا اکسیژنخواهی شیمیایی (COD) معیار شاخصی از میزان اکسیژنی است که توسط واکنشها در محلول مورد آزمایش مصرف می شود. این پارامتر معمولاً برحسب جرم اکسیژن مصرفی در حجم محلول بیان می شود که واحد آن در سیستم SI میلیگرم در لیتر (mg/L) است. از آزمون COD می توان برای تعیین مقدار مواد آلی موجود در آب و پساب استفاده کرد. رایج ترین کاربرد COD در تعیین مقدار مواد آلاینده قابل اکسید شدن موجود در آب های سطحی (مانند دریاچه ها و رودخانه ها) یا فاضلاب است. تعیین پارامتر COD از نظر کیفیت آب، با ارائه معیاری برای تعیین تأثیر یک پساب بر بدن دریافت کننده، بسیار شبیه به اکسیژن مورد نیاز بیوشیمیایی (BOD) مفید است.
اساس آزمایش COD این است که تقریباً تمام ترکیبات آلی می توانند به طور کامل با یک عامل اکسنده قوی تحت شرایط اسیدی به دی اکسید کربن اکسید شوند. مقدار اکسیژن مورد نیاز برای اکسید کردن یک ترکیب آلی به دی اکسید کربن، آمونیاک و آب، از معادله زیر برآورد می شود:
CnHaObNc + (n + a/4 – b/2 -3/4c) O2 → nCO2 + (a/2 – ۳/۲c) H2O + cNH3
ولی، این عبارت شامل نیاز اکسیژن ناشی از نیتریفیکاسیون، اکسید شدن آمونیاک به نیترات (معادله زیر) نمی شود.
NH3 + 2O2 → NO3– + H3O
دی کرومات پتاسیم، عامل اکسنده بسیار خوبی برای تعیین COD است، زیرا، آمونیاک را به نیترات اکسید نمی کند، بنابراین نیتریفیکاسیون در تست استاندارد COD گنجانده نشده است. سازمان بین المللی استاندارد یک روش استاندارد برای اندازه گیری اکسیژن مورد نیاز شیمیایی را در ISO 6060 توصیف می کند.
دی کرومات پتاسیم عامل اکسنده قوی در شرایط اسیدی است. اسیدیته معمولاً با افزودن اسید سولفوریک به دست می آید (معادله زیر).
CnHaObNc + dCr2O72- + (8d +c) H+ → nCO2 + [(a +8d – ۳c)/2] H2O + cNH4+ + 2dCr3
که در آن، d = 2n/3 + a/6 – b/3 – c/2 است. معمولاً از محلول ۰٫۲۵ نرمال دی کرومات پتاسیم برای تعیین COD استفاده می شود، اگرچه برای نمونه هایی با COD کمتر از ۵۰ میلیگرم در لیتر، غلظت کمتر دی کرومات پتاسیم ترجیح داده می شود.
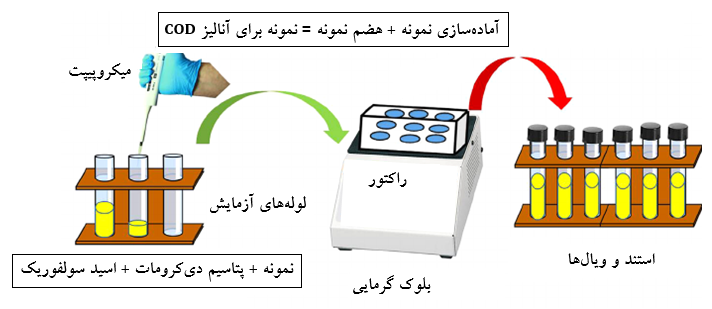
در فرآیند اکسایش مواد آلی موجود در نمونه آب، دی کرومات پتاسیم کاهش یافته (زیرا در تمام واکنشهای ردوکس، یک واکنشگر اکسید و دیگری احیا می شود) و یون کروم (III) تشکیل می شود. سپس، مقدار یون کروم (III) پس از پایان اکسایش تعیین می شود و به طور غیرمستقیم به عنوان اندازه ای از محتویات مواد آلی موجود در نمونه آب استفاده می شود.
تعیین مازاد دی کرومات پتاسیم
برای اینکه تمام مواد آلی موجود در نمونه آب یا پساب کاملاً اکسید شوند، باید مقدار زیادی دی کرومات پتاسیم (یا هر عامل اکسنده دیگر) وجود داشته باشد. هنگامی که اکسایش کامل شد، مقدار دی کرومات پتاسیم اضافی باید اندازه گیری شود تا اطمینان حاصل شود که مقدار کروم (III) را می توان با دقت تعیین کرد. برای انجام این کار، دی کرومات پتاسیم اضافی با سولفات آمونیوم آهن یا فروآمونیوم سولفات (FAS) تیتر می شود تا زمانی که تمام عامل اکسنده اضافی به کروم (III) احیا شود. معمولاً، از شناساگر اکسایش – کاهش فروئین (Ferroin) نیز در طول این مرحله تیتراسیون اضافه می شود. هنگامی که تمام دی کرومات اضافی کاهش یافت، شناساگر فروئین از آبی- سبز به قهوه ای مایل به قرمز تغییر رنگ می دهد. مقدار سولفات آمونیوم آهن اضافه شده معادل مقدار دی کرومات پتاسیم اضافی اضافه شده به نمونه اصلی است. لازم به توجه است که فروئین قرمز روشن از منابع تجاری قابل تهیه است، اما هنگامی که به نمونه هضم شده حاوی دی کرومات پتاسیم اضافه می شود، رنگ سبز از خود نشان می دهد. در طول تیتراسیون، رنگ شناساگر پس از رسیدن به نقطه پایانی، از رنگ آبی – سبز به قهوه ای مایل به قرمز تغییر می کند. شناساگر فروئین هنگام اکسید شدن از قرمز به آبی کم رنگ تغییر می کند.
تهیه معرف شناساگر فروئین
محلولی از ۱٫۴۸۵ گرم ۱-۱۰- فنانترولین مونوهیدرات به محلول ۶۹۵ میلی گرم FeSO4·۷H2O در آب مقطر اضافه می شود و محلول قرمز حاصل تا ۱۰۰ میلی لیتر رقیق می شود.
محاسبات
فرمول زیر برای محاسبه COD استفاده می شود:
COD = (8000(b–s) n) / V
که در آن، b حجم محلول فروآمونیوم سولفات (FAS) برای نمونه بلانک، s حجم آن برای نمونه اصلی، n نرمالیته محلول فروآمونیوم سولفات و V حجم نمونه است. اگر همه حجم ها برحسب میلی لیتر در فرمول گذاشته شود، COD برحسب میلی گرم بر لیتر به دست می آید.
مقدار COD را می توان از غلظت ترکیب قابل اکسیداسیون در نمونه نیز برآورد. این روش، بر اساس واکنش استوکیومتری ماده قابل اکسایش با اکسیژن برای تولید CO2 (فرض می شود که تمام C به CO2 )، H2O (فرض می شود که تمام H به H2O می رود) و NH3 قرار دارد. فرض می شود که N با استفاده از فرمول زیر به NH3 تبدیل می شود:
COD = (C/FW) × (RMO) × ۱۶
که در آن، C غلظت ترکیب قابل اکسایش در نمونه، FW وزن فرمول ترکیب قابل اکسایش در نمونه، RMO نسبت مول اکسیژن به مول ترکیب قابل اکسایش در واکنش به CO2، آب و آمونیاک است.
برای مثال، اگر نمونه ای دارای ۵۰۰ ppm فنل باشد:
C6H5OH + 7O2 → ۶CO2 + 3H2O
COD = (500/94) × ۷ × ۱۶ = ۵۹۶ ppm