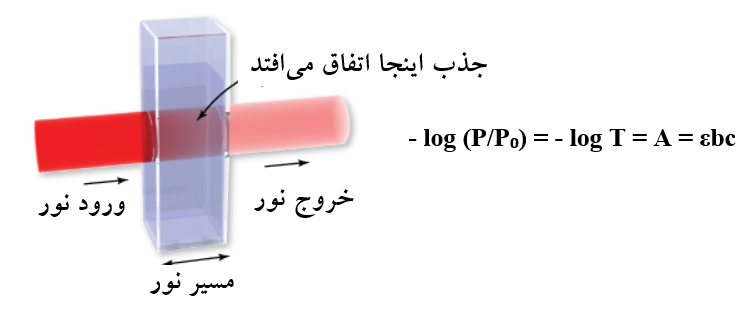
انرژی تابش برخوردکننده به واحد سطح در واحد زمان، توان تابش (P) نامیده می شود. اگر تابشی با توان P⁰ به محلولی که دارای مولکول های جاذب تابش است برخورد کند، مقداری از توان آن کاهش یافته و با توان P عبور خواهد کرد. تغییراتی که هنگام عبور تابش تکفام از یک سلول دارای محلول ماده جاذب اتفاق می افتد، در شکل (۱) نشان داده شده است. کمیت P1 توان تابش ورودی از منبع تابش، P⁰ توان تابش پس از عبور از یک دیوارۀ سلول، P توان تابش پس از عبور از درون محلول جاذب و P2 توان تابش پس از پیمودن آخرین دیوارۀ سلول است.
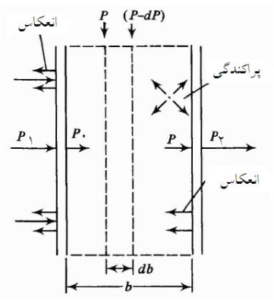
شکل ۱٫ عبور تابش الکترومغناطیس از سلولی به طول b که دارای محلولی ازیک ماده جاذب است.
کمیت مهم دیگر در اسپکترومتری یا اسپکتروفتومتری، عبور تابش (T) است که به صورت معادلۀ زیر تعریف می شود.
T = I / I0 = P2 / P1
این کمیت، معمولاً توسط دستگاه اسپکتروفتومتر یا طیف نورسنج اندازه گیری می شود. مقدار Ti عبور درون سیستمی تابش است و به صورت معادلۀ زیر تعریف می شود.
Ti = P / P0
معمولا ً T با Ti برابر است، زیرا کووت (Cuvette) یا سلول از موادی ساخته می شود که تابش را جذب یا پراکنده نمی کنند. هر تغییر جزئی از این نوع، با استفاده از سلول های (کووت های) مشابه که یکی محتوی نمونه و دیگری بدون نمونه است، به حداقل رسانده می شود. سلول دوم، شامل محلولی از تمام اجزای تشکیل دهنده محلول نمونه است، ولی فاقد ترکیب مورد تجزیه (آنالیت) است و به محلول سفیدیا محلول شاهد (بلانک، Blank) معروف است. همان طور که در شکل (۱) مشاهده می شود، در سلول علاوه بر جذب تابش توسط مولکول های نمونه، انعکاس از دیواره های بیرونی و داخلی سلول، پراکندگی توسط ذرات معلق یا حباب های هوا و جذب توسط سایر مولکول های موجود در محلول مورد آزمایش نیز اتفاق می افتد. اثر این پدیده ها نیز با استفاده از یک دستگاه دارای سیستم دوپرتویی (اسپکتروفتومتر دوپرتوی) به حداقل خواهد رسید. بوگر (Bouguer) و سپس لامبرت مشاهده کردند که مقدار انرژی یا شدت تابش جذب شده توسط لایه نازکی از محلول یک ماده جاذب، به ماهیت ماده و فرکانس تابش ورودی بستگی دارد و با ضخامت آن لایه متناسب است. در غلظت مشخصی از مادۀ جاذب، جمع روی یک سری لایه های نازک، به یک رابطه نمایی بین شدت تابش عبور کرده و ضخامت آن منجر می شود. این رابطه عموماً قانون لامبرت نامیده می شود. بیر (Beer) نشان داد، که در ضخامت معینی از یک محلول، ضریب جذب وارد شده توسط لامبرت با غلظت مادۀ جاذب در محلول نسبت مستقیم دارد. به عبارت دیگر، شدت تابش تکفام با افزایش غلظت مادۀ جاذب در محلول به طور نمایی کاهش می یابد. این رابطه عموماً قانون بیر نامیده می شود. از ترکیب این دو رابطه، قانون بیر –لامبرت (Beer –Lambert law) به دست می آید، که معادلۀ اساسی در اکثر روشهای طیف بینی است. این قانون بیان می کند که مقدار تابش جذب شده به وسیلۀ محلول (یا عبور کرده از آن)، تابع نمایی از غلظت مادۀ جاذب و طول مسیر طی شده توسط پرتو در نمونه است. برای به دست آوردن معادله بیر – لامبرت (با توجه به شکل ۱)، لایه ای از محلول به ضخامت بسیار کوچک db در نظر گرفته می شود، کاهش توان تابش (-dP ) توسط معادلۀ زیر تعیین می شود.
– dP / P = kcdb
که در آن k ،ثابت تناسب است. با انتگرال گیری نسبت به تمام طول سلول مادۀ جاذب (b)، می توان معادلۀ زیر، را نوشت.
A = εbc = – log (P/P0) = – log T
که در آن ε = k / 2.303 و ضریب جذب مولی نامیده می شود. بنابراین، غلظت (c) برحسب مول برلیتر یا مولاریته (M) و b برحسب سانتیمتر است. مقدار ε مشخصۀ مادۀ جاذب در یک طول موج خاص و در یک حلال خاص بوده و مستقل از غلظت و طول مسیر نور است. معادلۀ فوق گاهی قانون بوگر – بیر یا بیر – لامبرت و یا به اختصار قانون بیر نامیده می شود. هنگامی که برای غلظت واحدهای دیگری مانند گرم برلیتر، ppm و غیره به کار برده شود، به جای ε از علامت a استفاده می شود و a به طور کلی ضریب جذب نامیده می شود. در قانون بیر – لامبرت فرض بر این است که (۱) تابش برخورد کننده تکفام است، (۲) جذب در حجمی با سطح مقطع یکنواخت اتفاق می افتد و (۳) مواد جاذب در فرایند جذب، رفتاری مستقل از یکدیگر دارند. بنابراین، هنگامی که قانون بیر برای یک سیستم چندجزئی که در آن بین آنالیت های مختلف هیچگونه برهمکنشی وجود ندارد به کار می رود، جذب کل توسط معادلۀ زیر بیان می شود.
At = ε۱bc1 + ε۲bc2 + … + εibci
که در آن εi ضریب جذب مولی برای جزء جذب کننده و ci غلظت مولار آن جزء است. معادلۀ فوق اساس روش های کمّی برای تعیین اجزای تشکیل دهندۀ مخلوط مواد جاذب است.